Química en la Atmósfera
Atmósfera Terrestre
La Tierra es única entre los planetas de nuestro sistema solar porque tiene una atmósfera químicamente activa y rica en oxígeno. La atmósfera de Marte, por ejemplo, es mucho más delgada y está constituida por casi 90% de dióxido de carbono por otro lado, Júpiter no tiene una superficie sólida: está formada por 90% de hidrógeno, 9% de helio y 1% de otras sustancias.
Se cree que hace tres o cuatro mil millones de años, la atmósfera terrestre estaba formada sobre todo por amoniaco, metano y agua, con poco o nada de oxígeno libre. Es probable que la radiación ultravioleta (uV) del Sol haya penetrado la atmósfera, con lo cual se volvió estéril la superficie de la Tierra. Sin embargo, tal vez la misma radiación uV haya desencadenado las reacciones químicas (quizá debajo de la superficie) que con el tiempo permitieron la vida en la Tierra. Los organismos primitivos utilizaron energía solar para degradar el dióxido de carbono (generado por la actividad volcánica) y obtener el carbono que incorporaron a sus células. El oxígeno es el principal producto secundario de este proceso que se conoce como fotosíntesis. La fotodescomposición del vapor de agua por la luz uV es otra fuente importante de oxígeno. Con el tiempo, desapareció gran parte de los gases más reactivos como amoniaco y metano, y ahora nuestra atmósfera está formada principalmente por oxígeno y nitrógeno gaseosos. Las concentraciones atmosféricas de estos gases, uno de los cuales es reactivo (oxígeno) y el otro inerte (nitrógeno), están determinadas en gran medida por los procesos biológicos.
El nitrógeno molecular, con su enlace triple, es muy estable. Sin embargo, durante la fijación de nitrógeno biológica e industrial, es decir, la transformación del nitrógeno molecular en compuestos nitrogenados, el nitrógeno atmosférico gaseoso se convierte en nitratos y otros compuestos que las algas y las plantas son capaces de asimilar. Otro mecanismo importante para la producción de nitratos a partir del nitrógeno gaseoso es el que se produce por los relámpagos. Las etapas son:
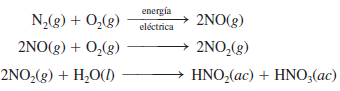
De esta forma se producen alrededor de 30 millones de toneladas de HNO3 al año. El ácido nítrico se convierte en sales de nitrato en el suelo, nutrientes que son tomados por las plantas, con las que se alimentan los animales para sintetizar proteínas y otras biomoléculas esenciales. La desnitrificación es un proceso que revierte la fijación de nitrógeno, con lo que se completa el ciclo. por ejemplo, ciertos organismos anaerobios descomponen los desechos animales, así como plantas y animales muertos, para producir nitrógeno molecular libre a partir de nitratos.
El ciclo de oxígeno es más complicado por el hecho de que adopta muchas formas químicas distintas. El oxígeno atmosférico se elimina por medio de la respiración y debido a varios procesos industriales (en especial la combustión), en los que se produce dióxido de carbono.
La fotosíntesis es el mecanismo fundamental de regeneración de oxígeno molecular a partir de dióxido de carbono y agua.
Los científicos dividen la atmósfera en varias capas de acuerdo con su composición y variación de temperatura. Hasta donde se manifiestan los fenómenos visibles, la región más activa es la troposfera, la capa de la atmósfera que contiene alrededor de 80% de la masa total del aire y casi todo el vapor de agua de la atmósfera. La troposfera es la capa más delgada de la atmósfera (10 km), pero ahí se llevan a cabo todos los fenómenos que influyen en el clima, como la lluvia, las tormentas eléctricas o los huracanes.

Destrucción del Ozono en la Atmósfera
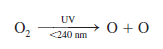
Según se ha mencionado, el ozono de la estratosfera evita que la radiación uV del Sol llegue a la superficie de la Tierra. La formación de ozono en esta región comienza con la fotodisociación del oxígeno molecular por la radiación solar:
Los átomos de O son muy reactivos y se combinan con las moléculas de oxígeno para formar ozono:
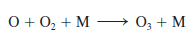
Donde M es cualquier sustancia inerte, como N2. La función que tiene M en esta reacción exotérmica es absorber parte del exceso de energía liberada y evitar la descomposición espontánea de la molécula de O3. La energía que no absorbe M se libera en forma de calor. (Cuando las moléculas de M regresan por sí mismas al estado basal, liberan más calor al entorno.)
Además, el ozono por sí mismo absorbe luz uV:
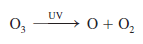
El proceso continúa cuando el O y el O2 vuelven a combinarse para formar O3 como se observa en la ecuación, con lo que se calienta aún más la estratosfera.
Si todo el ozono estratosférico se lograra comprimir en una sola capa sobre la Tierra ¡tendría sólo unos 3 mm de espesor! Aunque la concentración de ozono en la estratosfera es muy baja, es suficiente para filtrar (es decir, absorber) la radiación solar. La capa de ozono de la estratosfera es como un escudo que nos protege de la radiación uV, la cual puede causar cáncer de piel, mutaciones genéticas y destruir los cultivos y otras formas de vegetación.
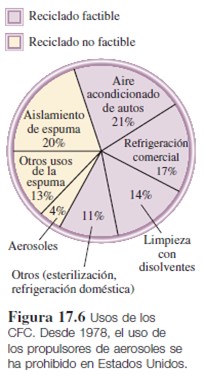
La formación y destrucción del ozono por procesos naturales es un equilibrio dinámico que mantiene constante su concentración en la estratosfera. Sin embargo, desde mediados de la década de 1970, los científicos se han preocupado por los efectos nocivos de ciertos clorofluorocarbonos (CFC) en la capa de ozono. Los CFC, que se conocen con el nombre comercial de freones, se sintetizaron por primera vez en la década de 1930. Como estos compuestos se licuan con facilidad, y en cierto modo son inertes, no tóxicos, no combustibles y volátiles, se han empleado como refrigerantes para acondicionadores de aire y refrigeradores, en lugar de amoniaco (NH3) y de dióxido de azufre (SO2) líquido, que es muy tóxico. También se emplean grandes cantidades de CFC para fabricar productos desechables, como vasos y platos, y como propelentes para aerosoles en latas y como disolventes para limpiar tarjetas de circuitos electrónicos. La mayor parte de los CFC que se usan en el comercio y la industria se descargan en la atmósfera.
Como son poco reactivos, los CFC se difunden con lentitud en la estratosfera sin sufrir cambios; ahí se descomponen por medio de la radiación uV:
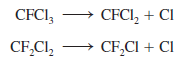
Los átomos de cloro son muy reactivos y experimentan las siguientes reacciones:
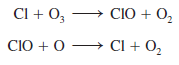
El resultado global la suma de las ecuaciones es la eliminación neta de una molécula de O3 de la estratosfera.
Los átomos de oxígeno en la ecuación provienen de la descomposición fotoquímica del oxígeno molecular y del ozono. Observe que el átomo de Cl funciona como catalizador en el mecanismo de la reacción representada por las ecuaciones, dado que no se consume; por tanto, puede participar en muchas reacciones de este tipo, un átomo de Cl es capaz de destruir más de 100 000 moléculas de O3 antes que alguna otra reacción lo elimine.

1.- ¿Qué significa la palabra fotodescomposición?
2.- ¿Qué gases principalmente constituyen la atmósfera?
3.- ¿Qué características presentan el oxígeno y el nitrógeno? ¿de que dependen sus concentraciones?
4.- ¿Qué producen los relámpagos y porqué es importante?
5.- ¿Qué es la tropósfera?
6.- ¿Cómo se forma el ozono? ¿cuál es su principal función?
7.- ¿Cuál es la fórmula química del ozono?
8.- ¿Qué efectos sobre la vida implica la destrucción de la capa de ozono?
9.- ¿Qué son los CFC?
10.- ¿Cuáles daños, sobre la atmósfera, provoca el uso de CFC?

El Juego del Dióxido de Carbono
El Juego del Dióxido de Carbono es una forma divertida y activa de explicar el efecto invernadero y la contribución humana al cambio climático global.
OBJETIVO:
– Demostrar el efecto invernadero, mostrando como el CO2 de la atmósfera atrapa el calor y aísla a la Tierra.
– Evidenciar que las actividades humanas influyen sobre la concentración de los gases de efecto invernadero de la atmósfera.
MATERIALES:
Una zona al aire libre, tiza, una pequeña bolsa con la frase “¿Qué han hecho los humanos?” escrita sobre ella, y tarjetas de acción representando acciones humanas que influyen sobre los niveles del CO2 de la atmósfera.
PROCEDIMIENTO:
Dibujar dos círculos concéntricos en el suelo, uno de aproximadamente dos pies de diámetro, y otro más ancho de unos 15 pies de diámetro. El círculo más pequeño representa la Tierra y el más grande la atmósfera terrestre. El juego se desarrolla en varias fases. Primeramente, se considera a dos estudiantes como moléculas de CO2 y se los coloca dentro de la atmósfera terrestre. Una vez allí ellos no pueden moverse. El resto de los estudiantes son rayos de sol y representan la energía solar. El objetivo del juego es que los rayos de sol entren en la atmósfera, toquen el círculo interior de la Tierra con el pie o la mano y luego escapen sin ser pillados por una molécula de CO2. Los rayos de sol pillados deben permanecer de pie en la atmósfera, los demás salen de ella hacia el espacio. Cada asalto dura aproximadamente 30 segundos y durante ese tiempo los rayos de sol intentan tocar a la Tierra sólo una vez. Esta simulación recrea el efecto invernadero: la energía del sol es atrapada como calor por el CO2 y otros gases y partículas de la atmósfera. Después del primer asalto, reúne los rayos de sol que se escaparon y forma un círculo alrededor de la atmósfera para examinar cuanta energía ha sido atrapada. Discute como puede afectar esto a la temperatura del planeta. Recuérdales a los estudiantes que una cierta cantidad de CO2 es necesaria para mantener al planeta lo suficientemente templado como para permitir el desarrollo de la vida. Durante el primer asalto, la mayor parte de la energía se escapará a la atmósfera porque los niveles de CO2 son bajos. Antes de continuar el juego, coloca todos los rayos de sol atrapados fuera de la atmósfera. Para el segundo asalto, aumenta el número de moléculas de CO2 en la atmósfera. Haz esto tomando de la bolsa “¿Qué han hecho los humanos?” una de las tarjetas (para esta ocasión, incluye sólo tarjetas que añadan CO2 a la atmósfera). Después de que un alumno lea la tarjeta, aumenta el número de moléculas de CO2 en el juego (según lo indicado por la tarjeta) y juega de nuevo. Para el tercero y los siguientes asaltos, pon todas las tarjetas en la bolsa para que los niveles de CO2 suban o bajen según que tarjeta sea extraída. Discute lo que ocurre cada vez. El juego debería demostrar que cuando se aumenta la cantidad de CO2, más calor queda atrapado (lo que se ilustra por los estudiantes rayos de sol que hay en la atmósfera) y la Tierra se calienta. Las tarjetas demuestran como incluso pequeñas acciones pueden disminuir la cantidad de los gases de efecto invernadero que emitimos a la atmosfera.







Deja un comentario